Valoración
ácido base y
sistema buffer
Cálculos de valoración ácido base de soluciones.
Valoración ácido-base
Cuando se desea determinar la concentración de un ácido o una base en una
disolución, éstos se hacen reaccionar con una base o un ácido patrón, respectivamente, cuya
concentración es conocida con precisión (es decir, con una incertidumbre menor al error
asociado al método de valoración). En el punto de equivalencia se produce un cambio
brusco del pH, que se puede determinar empleando un indicador, o bien un pH-metro, como
se explica abajo en más detalle. Cuando la reacción se produce entre un ácido o una base
fuertes, el pH correspondiente al punto de equivalencia será 7. Si un ácido débil se valora con
una base fuerte, el pH del punto de equivalencia es mayor que 7 (hidrólisis del anión
conjugado del ácido, que actuará como una base débil, aunque tanto más fuerte cuanto más
débil sea el ácido). Por el contrario, si una base débil se valora con un ácido fuerte, el pH del
punto de equivalencia es menor que 7 (hidrólisis del catión conjugado de la base, que actuará
como un ácido débil, aunque tanto más fuerte cuanto más débil sea la base.
A continuacion se te presentaran los siguientes ejercicios para que puedas entender de mejor manera con su respectivo video:
Ejercicios resueltos 01
Se valoran 0,25 litros de una disolución 0,2 molar de HCl
con 0,4 litros de una disolución 0,1 molar de NaOH . Calcular el pH de la
disolución resultanteSolucion 1
Ejercicios resueltos 02
Se valoran 0,25 litros de una disolución 0,2 molar de HCl
con 0,55 litros de una disolución 0,1 molar de NaOH . Calcular el pH de la
disolución resultante solucion 2
Ejercicios resueltos 03 Se valoran 0,25 litros de una disolución 0,4 molar de HCl
con 0,18 litros de una disolución 0,25 molar de Ca(OH)2 . Calcular
el pH de la disolución resultante Solucion 3
•Determinación del valor de pH y pOH de las
soluciones.
A 25 ºC tenemos que el producto iónico del agua es:
En ionización de agua pura, 1 mol de H3El+ está formado con 1 mol de OH– .
Puntos más importantes
- Podemos hacer la conversión entre [H+]open bracket, start text, H, end text, start superscript, plus, end superscript, close bracket y pHstart text, p, H, end text mediante las siguientes ecuaciones:
pH[H+]=−log[H+]=10−pH
- Podemos hacer la conversión entre [OH−]open bracket, start text, O, H, end text, start superscript, minus, end superscript, close bracket y pOHstart text, p, O, H, end text mediante las siguientes ecuaciones:
pOH[OH−]=−log[OH−]=10−pOH
- Para cualquier solución acuosa a 25∘C25, degrees, start text, C, end text:
pH+pOH=14start text, p, H, end text, plus, start text, p, O, H, end text, equals, 14.
Para cada aumento por un factor de 1010 en la concentración de [H+]open bracket, start text, H, end text, start superscript, plus, end superscript, close bracket, el pHstart text, p, H, end text disminuirá por 11 unidad y viceversa. Tanto la fuerza del ácido como su concentración determinan [H+]open bracket, start text, H, end text, start superscript, plus, end superscript, close bracket y el pHstart text, p, H, end text.

•Hacer los cálculos para predecir la capacidad buffer
de las soluciones.
Algunas veces es necesario preparar y guardar una solución con un pH constante. La preservación de dicha solución es aún más difícil que su preparación:
- si la solución entra en contacto con el aire, absorberá dióxido de carbono, CO2, y se volverá más ácida.
- si la solución se guarda en un recipiente de vidrio, las impurezas alcalinas "desprendidas" del vidrio pueden alterar el pH.
Las soluciones buffer o amortiguadoras son capaces de mantener su pH en valores aproximadamente constantes, aún cuando se agreguen pequeñas cantidades de ácido o base, o se diluya la solución.
Una disolución buffer o amortiguadora se caracteriza por contener simultáneamente una especie débil y su par conjugado:
- un ácido débil y la sal de su par conjugado
HA + H2O  A– + H3O+
A– + H3O+
- una base débil y la sal de su par conjugado
B + H2O  BH+ + OH–
BH+ + OH–
La disolución buffer debe contener una concentración relativamente grande de cada uno de los integrantes del par conjugado, de modo que:
- la especie ácida del sistema buffer pueda reaccionar con los iones OH– que se le añadan
- la especie básica del sistema buffer pueda reaccionar con la cantidad de iones H+ que se añadan

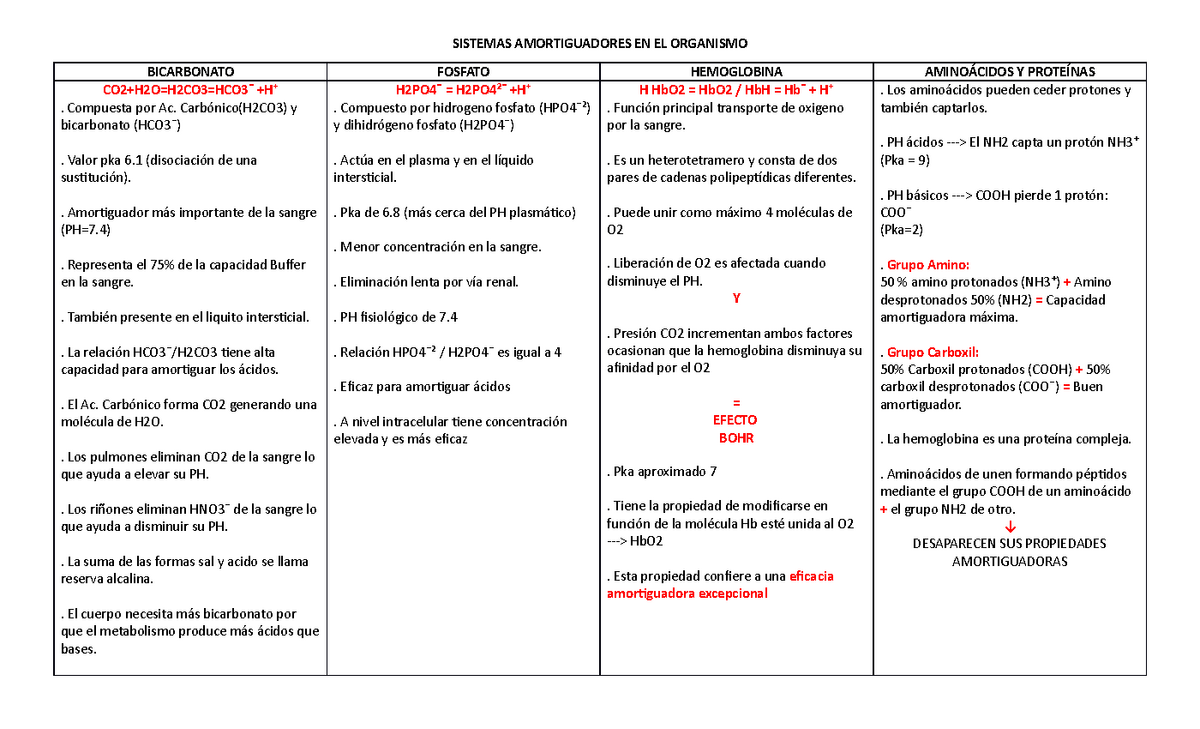
• Identificar los principales sistemas buffer que se
encuentran en el organismo
El organismo posee mecanismos para mantener el pH en valores compatibles con la vida,
una de ellos son los amortiguadores o sistemas buffer.
Teniendo en cuenta que el metabolismo intermedio (comprende todas las reacciones
relacionadas con el almacenamiento y la generación de energía metabólica) genera
diariamente una cantidad considerable de ácidos, estos deben ser regulados. El control
instantáneo de la carga ácida es realizado por sustancias amortiguadoras, buffer, o también
conocidas como ‘tampones
El organismo posee mecanismos para mantener el pH en valores compatibles con la vida,
una de ellos son los amortiguadores o sistemas buffer.
Teniendo en cuenta que el metabolismo intermedio (comprende todas las reacciones
relacionadas con el almacenamiento y la generación de energía metabólica) genera
diariamente una cantidad considerable de ácidos, estos deben ser regulados. El control
instantáneo de la carga ácida es realizado por sustancias amortiguadoras, buffer, o también
conocidas como ‘tampones
El organismo posee mecanismos para mantener el pH en valores compatibles con la vida,
una de ellos son los amortiguadores o sistemas buffer.
Teniendo en cuenta que el metabolismo intermedio (comprende todas las reacciones
relacionadas con el almacenamiento y la generación de energía metabólica) genera
diariamente una cantidad considerable de ácidos, estos deben ser regulados. El control
instantáneo de la carga ácida es realizado por sustancias amortiguadoras, buffer, o también
conocidas como ‘tamponesTampones fisiológicos
Son los sistemas encargados de mantener el pH de los medios biológicos dentro de
los valores compatibles con la vida. Permitiendo con ello la realización de funciones
bioquímicas y fisiológicas de las células, tejidos, órganos, aparatos y sistemas. Según
su naturaleza química, los amortiguadores se clasifican en orgánicos e inorgánicos y,
así mismo, atendiendo a su ubicación, se distribuyen en plasmáticos y tisulares

BH+ + OH–

Comentarios
Publicar un comentario